喜讯 ▏尚维高科获得欧盟新法规IVDR注册
尚维高科
本站
2022-09-01
125
2505
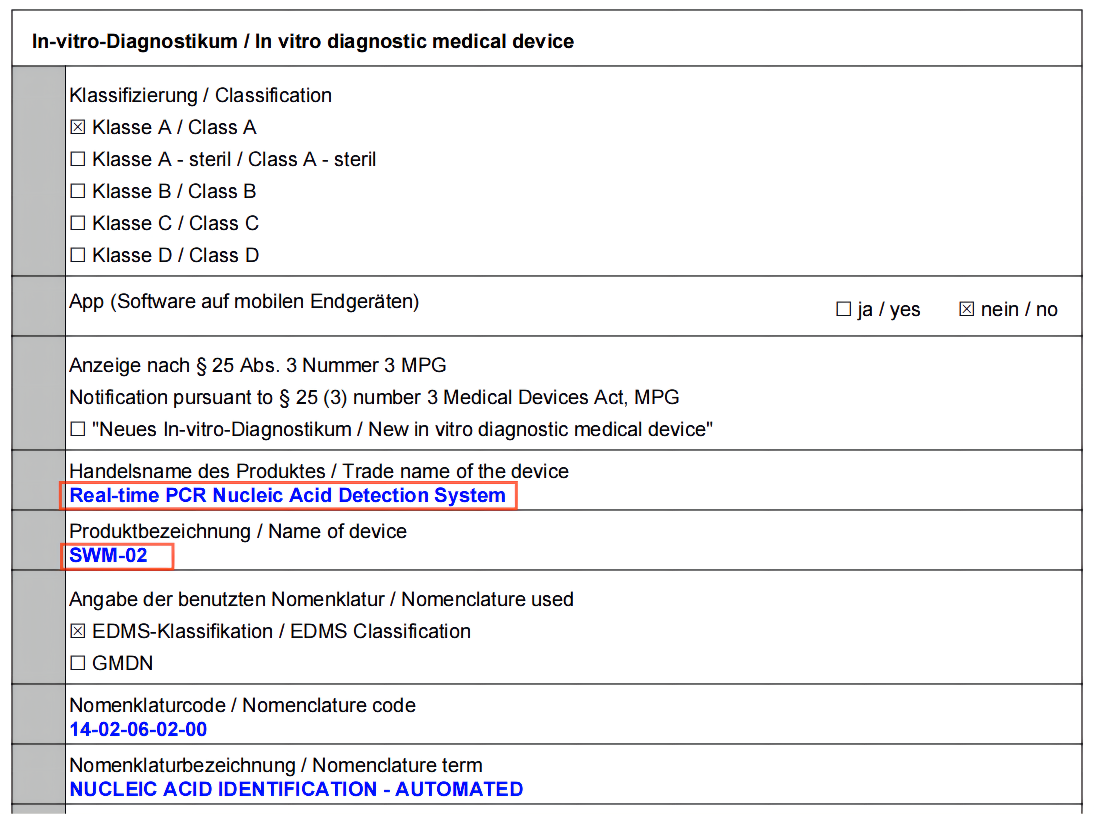
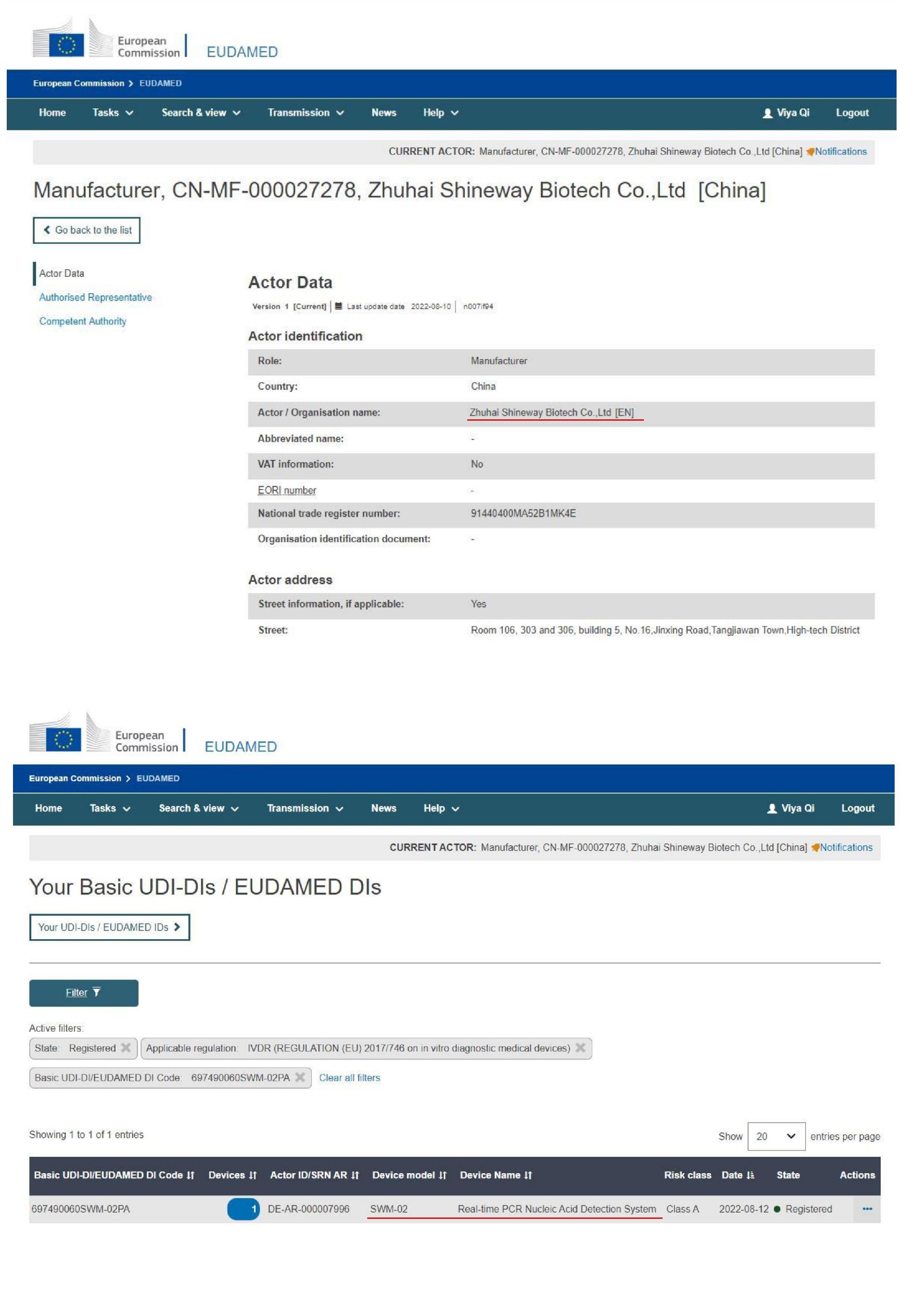
尚维高科自主研发的实时荧光PCR核酸检测系统(Real-time PCR Nucleic Acid Detection System,SWM-02)于近期再获欧盟市场准入资格。本次获得IVDR注册,不仅是尚维高科布局全球IVD市场的一步,更是公司产品高度贴合各国市场需求的体现。▲实时荧光PCR核酸检测系统(Real-time PCR Nucleic Acid Detection System,SWM-02)
尚维高科相信真正可持续的创新,必须是高质量产品并且对产业有正向激励作用。正值欧盟法规由IVDD CE向IVDR CE过渡,实时荧光PCR核酸检测系统SWM-02依然挺过严苛要求,完成注册,正面说明产品卓越精良。此外,实时荧光PCR核酸检测系统SWM-02抢抓新冠病毒“黄金24小时”窗口期,在香港跨境口岸持续近半年的快速核酸检测,成功阻截多例阳性个案前往内地,防止病毒外溢,最快15分钟可出核酸检测结果,真正做到即采即测。
未来创新步履不停,尚维高科将助力IVD行业发展,为社会带来更好的诊疗服务。
对于A类产品来说,通过IVDR注册是进入欧盟市场的必要条件。2017年4月5日欧盟正式签发的新版体外诊断医疗器械法规IVDR(EU 2017/746),相对于旧指令,新法规无论从上市前申请或上市后监督都进行了大规模的修订,内容更全面系统。随着 UDI 的实施和 EUDAMED 数据库的建立,新 IVDR 法规下上市的产品将实现全球多方全生命周期的监管,实现产品动态实时追踪的可能。这也标志着欧盟当局对医疗设备领域监管的进一步重视,同时也预示着在欧盟各成员国内医疗器械监管的尺度将得到进一步的统一。
- 返回
- 上一篇:中国工商银行深圳分行副行长潘强一行参访调研尚维高科
- 下一篇:喜讯 ▏尚维高科手持式居家产品获得国际多个认证